Suivre les essais cliniques dans l’AMS : IONIS / Biogen
En savoir plus...
ION 464 : thérapie basée sur l'ARN
IONIS-Pharma ouvre un essai clinique
à 40 patients AMS européens
 IONIS-Pharma relance l’essai clinique de phase 1 du composé ION464, traitement potentiel de l’AMS.
IONIS-Pharma relance l’essai clinique de phase 1 du composé ION464, traitement potentiel de l’AMS.
Société de biotechnologie implantée en Californie IONIS développe dans plusieurs types de pathologies les thérapies géniques « antisense oligonucleotides » (ASOs). Elle avait mis au point avec Biogen la piste thérapeutique BIIB101 devenue ION 464 et dont elle a repris le développement.
L’essai clinique de phase 1 ‘’HORIZON’’ lancé en novembre 2019 par la société américaine Biogen avait concerné en Europe une cohorte de 10 personnes volontaires souffrant d’AMS. Après une suspension de l’essai clinique et la remise aux Agences de Santé de données supplémentaires, une 2ième petite cohorte de patients AMS a pu tester ION464. Une 3ième cohorte de malades volontaires suivra, vraisemblablement au 3ième trimestre 2023, Au final, une quarantaine de patients européens participeront à cet essai.
Cet essai vise à évaluer la sécurité du produit, l’innocuité et la tolérabilité d’IONIS 464. Il est réalisé « en double aveugle contre placebo », ce qui signifie que, suivant un tirage au sort, 75 % des volontaires recevra le candidat-médicament et 25 %, le placebo, administrés par injection intrathécale (ponction lombaire).
L’essai sera mené dans 5 pays européens et 12 sites investigateurs qui n’accueilleront, chacun, pas plus de 3 patients volontaires :
● France
- Toulouse : Hôpital Purpan, (l’essai y sera bientôt ouvert)
- Paris : Groupe Hospitalier de la Pitié-Salpêtrière
- Lyon : Hôpital Pierre Wertheimer
● Allemagne
- Ulm
- Hanovre
- Marburg
- Dusseldorf
● Autriche : Université de médecine d’Innsbruck
● Royaume Uni
- Londres
- Oxford
● Portugal : Lisbonne
Avant d’être sélectionnés pour l’essai, les candidats seront suivis pendant 6 semaines pour des observations et des tests. Les volontaires retenus seront alors inclus dans l’essai. Le traitement sur 12 semaines comportera 2 injections, du placebo ou du composé, la première lors de la première visite, la 2ième, 12 semaines plus tard. Une période d’observation de 24 semaines suivra cette phase de traitement.
Après une période de 36 semaines, tous les patients inclus dans l’étude, qu’ils aient reçu le composé ou le placebo, se verront alors proposer de participer à une extension « en ouvert » de l’étude. Pendant cette 2ième période d’une durée totale de 96 semaines - 72 semaines de traitement suivies de 24 semaines d’observation – ils recevront tous le composé ION464.
La 1ière partie de cette étude de phase 1 vise à évaluer « l'innocuité, la tolérabilité et la pharmacocinétique (étude du devenir d'une substance active après son administration dans l'organisme) du ION464 administré par voie intrathécale aux adultes atteints d'atrophie multi-systématisée ». La 2ième partie permettra d’en tester l'innocuité et la tolérabilité à long terme.
Les informations officielles sur cet essai se trouvent sur le site ClinicalTrials qui recense la quasi-totalité des essais cliniques organisés sur toute la planète.
ION464, un essai de thérapie basée sur l'ARN
ION464 est un oligonucléotide antisens (ASO). Il va cibler l’ARN messager (ARNm) du gène SNCA qui contrôle la production d’alpha-synucléine, cette protéine qui s'accumule de manière aberrante dans le cerveau des patients atteints d’AMS, considérée comme l'une des principales causes de la maladie.
ION464 ne va pas toucher à l’ADN des patients ni à aucun de leurs gènes. Il modifiera seulement les copies, les « plans d’exécution », que l’organisme utilise pour produire la protéine incriminée. On suppose que la réduction de l'ARNm du gène SNCA et, par la suite, la synthèse réduite de la protéine alpha-synucléine diminueront les effets toxiques de l’alpha-synucléine chez les patients atteints d’AMS, sans mutations du gène SNCA dans l’ADN.
La technologie antisens d'Ionis
Ionis est un laboratoire de biotechnologie qui développe exclusivement des thérapies antisens - également appelées ‘’oligonucléotides antisens’’, ou ‘’ASO’’ - conçues pour se lier à l'ARN, stoppant le processus de création d'une protéine pathogène. Il décrit ainsi son approche de la maladie :
Approches traditionnelles contre antisens.
« Pour comprendre comment Ionis utilise la technologie antisens pour révolutionner la découverte de médicaments, nous devons d'abord examiner le fonctionnement des médicaments traditionnels dans le corps.
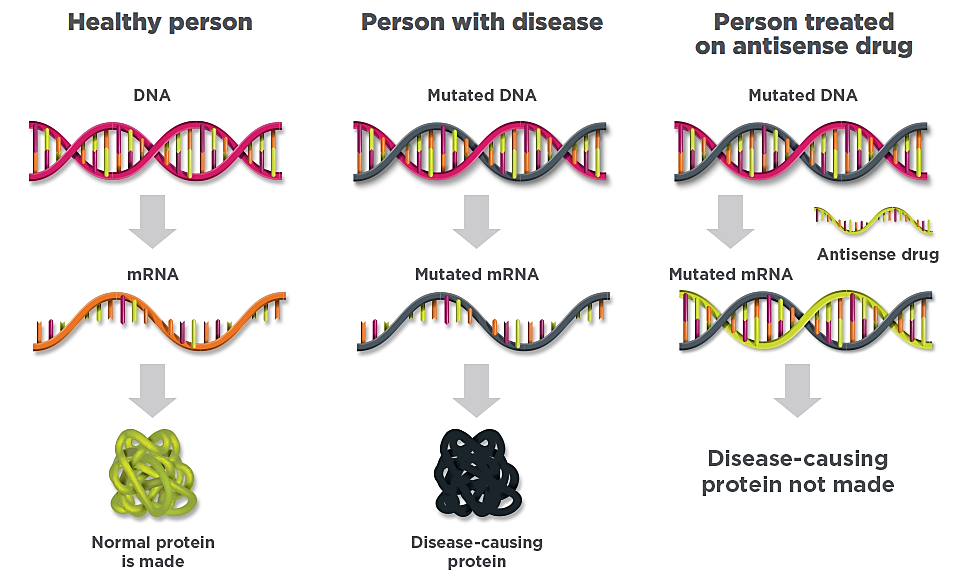 Le corps humain est composé de milliards de cellules, chacune contenant l'information génétique unique, ou ADN, qui définit une personne. L'ADN contient des instructions pour fabriquer toutes les protéines du corps humain.
Le corps humain est composé de milliards de cellules, chacune contenant l'information génétique unique, ou ADN, qui définit une personne. L'ADN contient des instructions pour fabriquer toutes les protéines du corps humain.
Les protéines sont des éléments de base cruciaux pour la structure et le fonctionnement de tous les organes et systèmes du corps humain. Mais la surproduction ou la sous-production d'une protéine, ou la production d'une protéine mutée, sont des causes courantes de nombreuses maladies humaines. Depuis plus de 100 ans, la plupart des médicaments traditionnels comme les inhibiteurs à petites molécules ou, plus récemment, les thérapies à base d'anticorps ciblent ces protéines une fois qu'elles sont produites et qu’elles causent des dommages dans le corps.
Les thérapies antisens modifient le processus de production d'une protéine avant même qu'il ne commence. Pour construire une protéine, une cellule doit faire une copie de l'ADN, qui contient des instructions spécifiques sur la façon de fabriquer cette protéine particulière. Cette copie, appelée ARN messager (ARNm), transmet les instructions à la partie de la cellule où les protéines sont fabriquées.
Les thérapies antisens sont conçues pour rechercher, lier et détruire un ARNm d'une manière hautement spécifique, de sorte que la quantité de protéines pathogènes est considérablement réduite. Les thérapies antisens peuvent également traiter les maladies causées par trop peu de protéines en augmentant la production de la protéine, restaurant ainsi la protéine à des niveaux normaux. »
mise à jour : avril 2024
Glossaire
Alpha-synucléine
Les dysfonctionnements de l’alpha-synucléine sont à l’origine de plusieurs pathologies appelées « synucléinopathies » : l’AMS, la maladie de Parkinson, la maladie à corps de Lewy.
L’alpha-synucléine est une petite protéine abondante dans le cerveau et nécessaire à son  fonctionnement.
fonctionnement.
Pour des raisons inconnues, cette protéine peut adopter une mauvaise conformation, jusqu’à former des agrégats. Ces agrégats vont encombrer les neurones, mais aussi, dans l’AMS, les oligodendrocytes, ces cellules de soutien des neurones. De plus, l’alpha-synucléine mal repliée propage de cellule en cellule son fonctionnement anormal. C’est pourquoi cette protéiné encore mal connue, ses différentes souches, son mode de propagation sont la principale cible des stratégies thérapeutiques visant l’AMS et les maladies voisines.
En savoir plus :
Voir la page "Au commencemen de la recherche, les cellules oligodendriales"
Voir la vidéo « l’alpha-synucléine dans l’AMS », par Pierre-Olivier Fernagut, coordonnateur du Conseil scientifique d’Aramise.
