Test article
En savoir plus...
Traitements de fond de l'AMS : le point en 2022
Une équipe de spécialistes constituée autour du Département de neurologie de l’Université médicale d’Innsbruck en Autriche a publié en juillet 2022 un panorama très complet des différentes stratégies thérapeutiques pour lesquelles des essais pré-cliniques et cliniques sont en cours ou en préparation. Pour mieux comprendre le pipeline ci-contre.(
l'article original en anglais
sa traduction en français
Suivre les essais cliniques
Nous sommes tous en attente d’avancées décisives de la recherche en matière de compréhension des mécanismes de l’AMS, de diagnostic, mais surtout DU ou DES médicaments qui viendront à bout de cette maladie.
Pour nous, malades et aidants, cette attente est longue.
Mais, sachons-le, les chercheurs travaillent et progressent.
Nous vous proposons ci-dessous le « pipeline » des candidats-médicaments concernant l’AMS, qu’ils en soient au stade du développement préclinique ou d’essai sur les humains.
Le « pipeline », dans le vocabulaire du laboratoire pharmaceutique, c’est l’ensemble des molécules et composés qu’il a conçus et qui en sont à des stades différents de la recherche et du développement.
D’un simple « clic » sur chaque ligne de ce pipeline, vous accéderez à la page de présentation du laboratoire, du candidat-médicament, de l’essai engagé et aux articles le concernant, en français et en anglais
Dans cette version 2023 du pipeline, nous voyons apparaître ou se poursuivre les essais cliniques de stratégies nouvelles visant l’alpha-synucléine :
● les cellules souches testées aux USA à la Mayo Clinic
● les oligonucléotides antisens avec l’essai initié par Biogen et mené par IONIS Pharma,
● l’immunisation passive avec Lundbeck et Takeda
● le métabolisme du fer dans le cerveau, avec Alterity Therapeutics
Avant la diffusion d’un nouveau médicament,
plusieurs phases d’essais cliniques sont nécessaires
Les essais cliniques chez l’homme dont les différentes phases apparaissent ci-dessous sont précédés de tests sur les animaux. Puis 3 phases d’essais doivent être franchies avant d’arriver à l'autorisation de mise sur le marché.
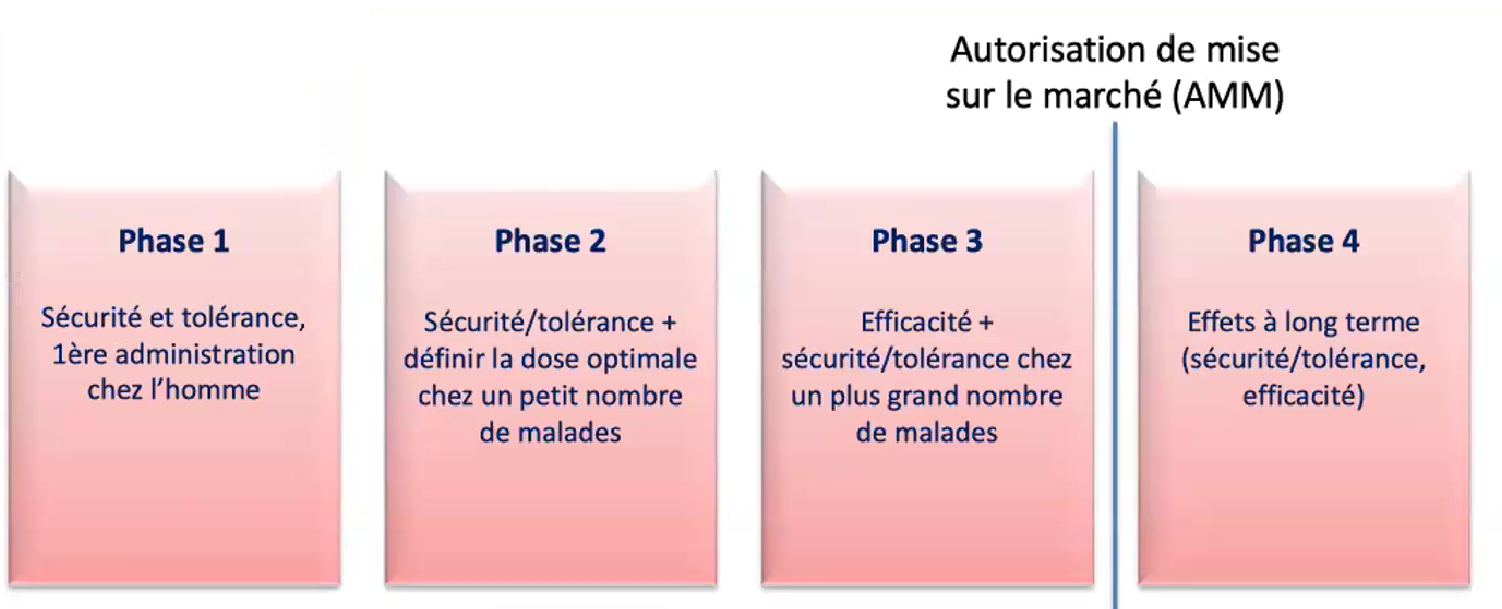
● L’essai de phase 1 est une étude de petite envergure menée sur 20 à 30 volontaires sains, pour s'assurer qu'il n'y a pas de problème de sécurité et de tolérance du candidat-médicament. Ce premier test sur les humains dure en général entre 12 et 18 mois, suivis de 6 mois d’analyse des résultats.
● L’essai de phase 2 implique pour la première fois les patients. Un petit groupe de 40 à 60 patients répartis souvent dans différents pays est recruté. Cette phase 2 vise encore à s’assurer qu'il n'y a pas de problème de sécurité et de tolérance du médicament. Elle commence aussi à tester différentes doses du candidat-médicament afin de déterminer celle qu’il sera le plus intéressant de tester dans l’essai de phase 3. Cet essai de phase 2 dure souvent 1 an pour les patients concernés, suivi d’une année d’analyse des données.
● L’essai de phase 3 vise à évaluer l’efficacité du traitement chez un nombre important de patients. Dans une maladie très répandue, il s’agira de plusieurs milliers de sujets ; dans une maladie rare comme l’AMS, de quelques centaines de personnes, autour de 300 vivant dans différents pays. Là encore, l’essai durera un an, voire 18 mois pour les malades et sera suivi d’un an d’étude des résultats avant que le laboratoire ne dépose une demande d’autorisation de mise sur le marché.
Dans le cas de maladies très répandues les agences règlementaires peuvent demander un 2ième essai de phase 3.
Les maladies rares font l’objet de conditions particulières. Compte-tenu de la rareté de la maladie et donc des difficultés de recrutement de candidats aux essais, une solide étude de phase 2 suffit parfois, surtout quand il n’existe aucun traitement pour la pathologie, à obtenir une autorisation de mise sur le marché.
Cette procédure accélérée intéresse aussi les laboratoires pharmaceutiques qui développent les nouvelles molécules.
Mise à jour septembre 2023
