Suivre les essais cliniques dans l’AMS : Lundbeck
MASCOT, l’essai clinique de Lundbeck commence
En France, 30 à 40 patients AMS pourront tester l’amlenetug
 Les Centres de référence de Bordeaux et Toulouse ainsi que le Centre associé de Montpellier commencent le recrutement de patients-candidats à l’essai clinique de l’amlenetug.
Les Centres de référence de Bordeaux et Toulouse ainsi que le Centre associé de Montpellier commencent le recrutement de patients-candidats à l’essai clinique de l’amlenetug.
Le Centre de référence de Paris-La Pitié Salpêtrière et les Centres de compétences de Lille, Marseille et Rennes s’y préparent et devraient commencer bientôt les recrutements.
MASCOT est le nom de l’essai clinique de phase 3 de l’amlenetug, une immunothérapie anti-alpha-synucléine, conçue par Lundbeck , société pharmaceutique internationale d’origine danoise .Testée aux USA et au Japon depuis novembre 2021 dans un essai de phase 2 chez des personnes souffrant d’AMS, elle a donné des résultats encourageants sur l’évolution de la maladie.
MASCOT concernera concernera un total de 360 participants aux Etats-Unis, au Japon, en Corée et en Europe.
L’essai se déroulera sur une longue durée :
● 3 à 6 semaines d’observation préalable à l’inclusion,
● 72 semaines d’administration par intraveineuse, différenciée selon 3 groupes tirés au sort
- de l’amlenetug à dose faible
- de l’amlenetug à dose plus élevées
- d’un placebo
● 72 nouvelles semaines, facultatives, dite d’extension de traitement en ouvert (OLE), pendant lesquelles tous les participants à l’essai qui le souhaitent recevront l’amlenetug
Pendant toute la durée de l’essai, le traitement est administré par voie intraveineuse toutes les 4 semaines. Ce qui suppose de nombreux déplacements jusqu’aux centres d'investigation clinique.
L’essai pourra concerner des patients qui ne sont pas suivis dans l’un des 7 centres engagés dans cet essai. Les autres Centre de compétences et Centres associés ont été invités par le Pr Meissner, coordonnateur de l’essai en France, à adresser aux sites investigateurs quelques patients suffisamment en forme et motivés par rapport aux contraintes du déplacement imposé toutes les 4 semaines.
L'amlenetug est un traitement d’immunothérapie dite « passive ». Des anticorps régulièrement administrés aident le système immunitaire à éliminer les protéines alpha-synucléines mal repliées qui s’agglomèrent dans les cellules nerveuses et qui se diffusent d’une cellule à l’autre. L’anticorps amlenetug a reçu la désignation de « médicament orphelin » par l'Agence européenne des médicaments (EMA). Cette désignation qui concerne les médicaments contre les maladies rares en facilite le développement et la mise sur le marché si leurs effets sont concluants.
▪ 22 mai 2025 : Alors que Lundbeck lance MASCOT un essai de phase III de Lu AF82422 dans l’AMS, la revue ‘’Nature npj’’ publie un article rédigé par les chercheurs de la société. Ils décrivent les recherches fondamentales et pré-cliniques qui ont permis la mise au point de l'amlenetug.
L’anticorps monoclonal humain Amlenetug (Lu AF82422) se lie spécifiquement aux formes anormales de l’α-synucléine. Il bloque la propagation des agrégats d’α-synucléine dans des modèles cellulaires et animaux et empêche l’absorption de ces agrégats par les cellules nerveuses ce qui en réduit la formation.
Ce traitement ne vise pas à guérir, ni à réparer les lésions déjà présentes, mais à freiner l’aggravation de la maladie en empêchant la protéine α-synucléine de former de nouveaux dépôts toxiques
Lire la synthèse en français et l’original en anglais de l’étude
▪ 27 novembre 2024 : Lundbeck lance un essai de phase III de l'amlenetug (Lu AF82422) pour le traitement de l'atrophie multi-systématisée
MASCOT, un essai mondial de phase III randomisé, en double aveugle et contrôlé par placebo, évaluera l'efficacité et l'innocuité de l'amlenetug dans le traitement de l'atrophie multi-systématisée (AMS).
Lire l’article en français et en anglais
▪ 29 septembre 2024 : L'anticorps anti-a-synucléine Lu AF82422 montre un potentiel de modification de la maladie dans l'essai de phase 2 AMULET sur l'AMS
Lu AF84222 a été considéré comme bien toléré, avec des effets thérapeutiques plus importants observés dans un sous-groupe de patients présentant une atrophie multi-systématisée moins altérée.
Par Wolfgang Singer, MD, professeur associé de neurologie à la Mayo Clinic Rochester et président du
groupe de travail AMS de la société savante internationale MDS, International Parkinson and Movement Disorder Society.
Lire l’article en français et en anglais
▪ 8 novembre 2021 : Lundbeck lance une étude de phase II pour un nouveau traitement potentiel de l'atrophie multi-systématisée
L’étude intitulée AMULET vise à confirmer la capacité de Lu AF82422 de ralentir la progression de l'atrophie multi-systématisée (AMS.
Lire l’article en français et en anglais
▪ 28 octobre 2021 : Lundbeck publie les résultats d’une étude pré-clinique de Lu AF82422
Testé sur des modèles animaux, Lu AF82422 est un anticorps monoclonal (mAb) d'immunoglobuline humaine G1 (IgG1) qui reconnaît toutes les principales espèces d'alpha-synucléine (monomère et oligomère ; formes tronquées N- ou C-terminales). Il vise l'alpha-synucléine oligomère extracellulaire présente dans le système nerveux central (SNC), et éventuellement dans le système nerveux périphérique, chez les patients atteints de la maladie de Parkinson ou d’AMS. Son mécanisme est de se lier à l'alpha-synucléine pathologique extracellulaire et d'en inhiber l'ensemencement et la propagation à d'autres cellules.
Lire l’article en français et en anglais
Mécanismes présumés de l’immunothérapie
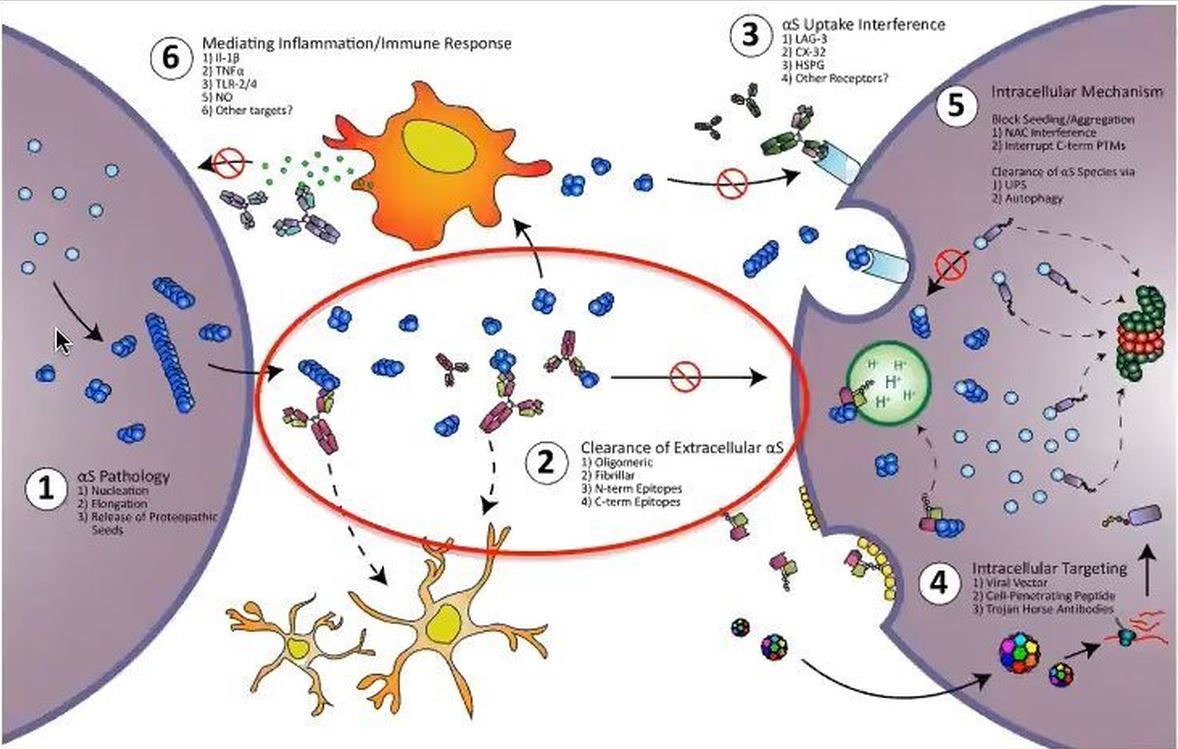
Cette image montre deux grandes cellules coloriées en gris. Dans celle de gauche on voit, en bleu, des protéines d’alpha-synucléine mal repliées. Elles sont isolées ou anormalement agglomérées en agrégats de tailles différentes. Plus ces agrégats sont gros, plus la cellule a du mal à les éliminer. Ces agrégats peuvent sortir de la cellule envahie, dans l’espace extra-cellulaire (en blanc). Ils peuvent alors être captés par l’autre cellule du cerveau, à droite, dans laquelle ils provoqueront le même processus d’agrégation et les mêmes dégâts. C’est ainsi que le mécanisme de formation de ces agrégats toxiques d’alpha-synucléine se propage, au fil de de l’évolution de la maladie.
L'immunothérapie vise à empêcher cette diffusion de la protéine alpha-synucléine déviante d’une cellule à l’autre. Elle aide le système immunitaire constitué par les cellules gliales de la microglie (en jaune, dans l’espace blanc entre les cellules), à repérer et éliminer l’alpha-synucléine toxique.
mise à jour : 01 juillet 2025
Glossaire
Alpha-synucléine
Les dysfonctionnements de l’alpha-synucléine sont à l’origine de plusieurs pathologies appelées « synucléinopathies » : l’AMS, la maladie de Parkinson, la maladie à corps de Lewy.
L’alpha-synucléine est une petite protéine abondante dans le cerveau et nécessaire à son  fonctionnement.
fonctionnement.
Pour des raisons inconnues, cette protéine peut adopter une mauvaise conformation, jusqu’à former des agrégats. Ces agrégats vont encombrer les neurones, mais aussi, dans l’AMS, les oligodendrocytes, ces cellules de soutien des neurones. De plus, l’alpha-synucléine mal repliée propage de cellule en cellule son fonctionnement anormal. C’est pourquoi cette protéiné encore mal connue, ses différentes souches, son mode de propagation sont la principale cible des stratégies thérapeutiques visant l’AMS et les maladies voisines.
En savoir plus :
Voir la page "Au commencemen de la recherche, les cellules oligodendriales"
Voir la vidéo « l’alpha-synucléine dans l’AMS », par Pierre-Olivier Fernagut, coordonnateur du Conseil scientifique d’Aramise.
Cellules gliales
Ce sont les cellules qui forment l’environnement des neurones. Elles jouent un rôle de soutien et de protection du tissu. Elles entourent les neurones et participent au contrôle de l'en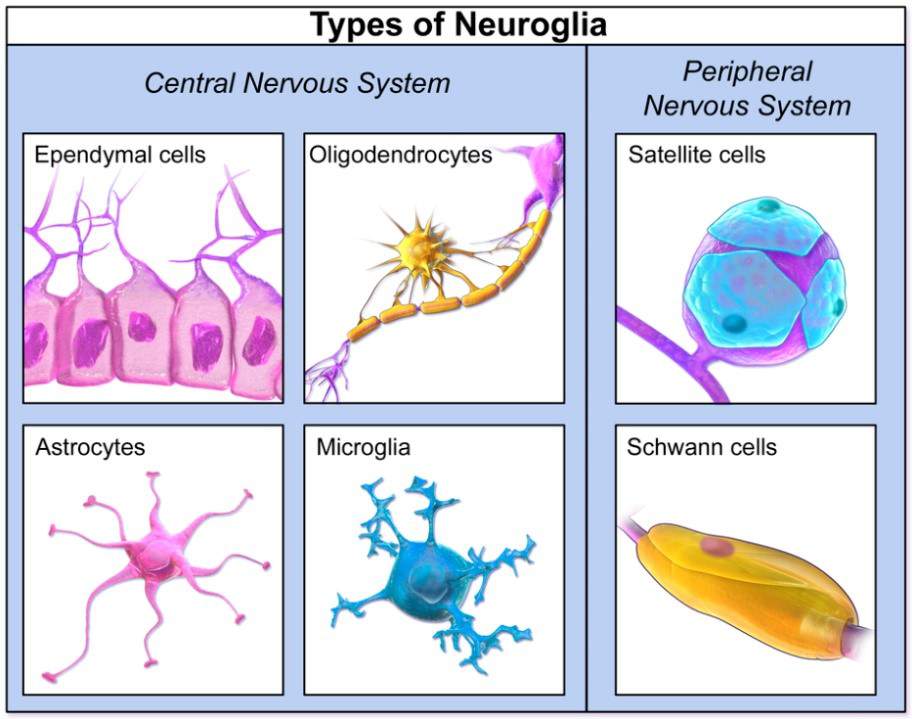 vironnement chimique et électrique en leur fournissant des nutriments, de l’oxygène et en éliminant leurs déchets. Ces cellules produisent par exemple la myéline, une substance qui sert d'isolant aux fibres nerveuses.
vironnement chimique et électrique en leur fournissant des nutriments, de l’oxygène et en éliminant leurs déchets. Ces cellules produisent par exemple la myéline, une substance qui sert d'isolant aux fibres nerveuses.
Il y aurait, dans notre système nerveux, à peu près autant de cellules gliales que de neurones, soit environ 100 milliards. Les cellules gliales sont différentes au sein du système nerveux central et du système nerveux périphérique, elles n’ont pas non plus la même origine dans leur développement.
● Les cellules gliales du système nerveux central (SNC) qui dérivent des glioblastes du tube neuronal embryonnaire, sont de 3 types :
- les astrocytes qui assurent un lien fonctionnel entre vaisseaux et neurones, apportant substrats énergétiques aux neurones et les débarrassant des produits de dégradation ;
- les oligodendrocytes à l’origine de la gaine de myéline des neurones ;
- les épendymocytes qui forment les parois qui délimitent les différentes cavités du SNC et sont responsables de la synthèse du liquide céphalo-rachidien (LCR)
● Les cellules gliales du système nerveux périphérique (SNP), dérivent des crêtes neurales embryonnaires. Ce sont les cellules satellites avec une fonction analogue à celle des astrocytes et les cellules de Schwann qui forment chacune la gaine d’un seul neurone, à la différence des oligodendrocytes qui « s’occupent » chacun d’une dizaine de neurones.
Immunothérapie
L’immunothérapie dans les synucléinopathies.
A) Pour des raisons encore mal élucidées, génétiques ou environnementales, un mauvais repliement de l’α-synucléine (en blanc l’α-synucléine normale, en jaune l’α-synucléine mal conformée) survient en intracellulaire et conduit à la formation d’agrégats oligomèriques (*) puis de fibrilles (**). Les agrégats peuvent être ensuite relargués en extracellulaire.
B) Les agrégats d’α-synucléine peuvent alors pénétrer dans de nouvelles cellules nerveuses, déclencher le mauvais repliement de l’α-synucléine normale de la cellule et provoquer la formation d’agrégats.
1) Via leur portion Fab (fragment antigen binding), les anticorps peuvent fixer les formes anormales d’α-synucléine afin de les neutraliser et/ou de favoriser leur dégradation.
2) Via leur portion Fc (fragment cristallisable), les anticorps peuvent se lier à des récepteurs situés à la surface des neurones et favoriser ainsi l‘élimination intracellulaire de l’α-synucléine, en particulier au niveau des lysosomes.
3) Les anticorps peuvent aussi se lier par leur portion Fab aux récepteurs qui permettent l’absorption des agrégats d’α-synucléine et ainsi empêcher leur internalisation.
4) Des intracorps peuvent être administrés via un plasmide et agir en intracellulaire où ils favorisent la dégradation des agrégats et/ou empêchent l’agrégation des monomères.
5) Les complexes anticorps–agrégats d’α-synucléine peuvent aussi se lier à des récepteurs présents à la surface de la microglie et déclencher leur phagocytose.
L’immunothérapie active, ou vaccination, consiste à administrer un antigène (ici l’α-synucléine anormale ou des fragments d’α-synucléine anormale), pour déclencher une production d’anticorps spécifique, par le système immunitaire (réponse humorale).
L’immunothérapie passive consiste en l’administration directe d’anticorps produits ex vivo, dirigés contre l’α-synucléine anormale ou des fragments de cette dernière
Source : Revue Neurologies
MDS
Movement Disorder Society
International Parkinson and Movement Disorder Society
L'International Parkinson and Movement Disorder Society (MDS) est une société savante internationale. Basée à Milwaukee, aux USA, elle rassemble plus de 11 000 cliniciens, scientifiques et professionnels de la santé qui se consacrent à l'amélioration des soins aux patients atteints de troubles du mouvement, maladie de Parkinson et autres troubles parkinsoniens, dont l’AMS. https://www.movementdisorders.org/
Le Professeur Meisner fait partie de son Comité exécutif.
Un groupe de travail international spécifique sur l’AMS existe au sein de la MDS :
En font partie, pour la France, Erwan Bezard, Pierre-Olivier Fernagut, Anne Pavy-LeTraon, Wassilios Meissner, Ronald Melki, Francois Tison, Olivier Rascol.
Pour la révision des critères diagnostiques de l’AMS, une task-force co-présidée par l’Autrichien Gregor Wenning et l’Américain Horacio Kaufmann a été créée au sein de la MDS :
La MDS a créé des « sections régionales » sur les différents continents . Margherita Fabbri est membre du Comité exécutif de la section européenne de la MDS
